中國虎網 2016/3/7 0:00:00 來源:
未知
根據2015年11月4日第十二屆全國人民代表大會常務委員會第十七次會議審議通過的《關于授權國務院在部分地方開展藥品上市許可持有人制度試點和 有關問題的決定》,國家食品藥品監督管理總局制定了化學藥品注冊分類工作改革方案,已經國務院同意,現予以公告,并自公告發布之日
起實施。
附件:化學藥品注冊分類改革工作方案
食品藥品監管總局
2016年3月4日
附件
化學藥品注冊分類改革工作方案
為鼓勵新藥創制,嚴格審評審批,提高藥品質量,促進產業升級,對當前化學藥品注冊分類進行改革,特制定本工作方案。
一、調整化學藥品注冊分類類別
對化學藥品注冊分類類別進行調整,化學藥品新注冊分類共分為5個類別,具體如下:
1類:境內外均未上市的創新藥。指含有新的結構明確的、具有藥理作用的化合物,且具有臨床價值的藥品。
2類:境內外均未上市的改良型新藥。指在已知活性成份的基礎上,對其結構、劑型、處方工藝、給藥途徑、適應癥等進行優化,且具有明顯臨床優勢的藥品。
3類:境內申請人仿制境外上市但境內未上市原研藥品的藥品。該類藥品應與原研藥品的質量和療效一致。
原研藥品指境內外首個獲準上市,且具有完整和充分的安全性、有效性數據作為上市依據的藥品。
4類:境內申請人仿制已在境內上市原研藥品的藥品。該類藥品應與原研藥品的質量和療效一致。
5類:境外上市的藥品申請在境內上市。
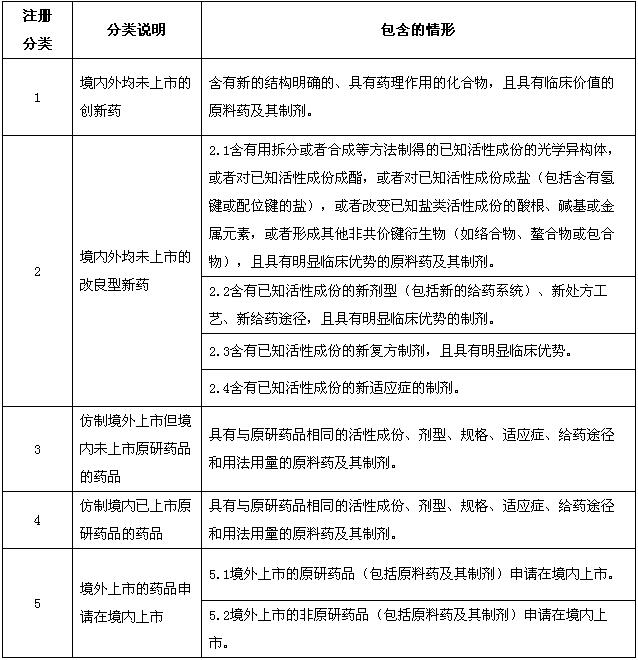
注:1.“已知活性成份”指“已上市藥品的活性成份”。
2.注冊分類2.3中不包括“含有未知活性成份的新復方制劑”。
二、相關注冊管理要求
(一)對新藥的審評審批,在物質基礎原創性和新穎性基礎上,強調臨床價值的要求,其中改良型新藥要求比改良前具有明顯的臨床優勢。對仿制藥的審評審批,強調與原研藥品質量和療效的一致。
(二)新注冊分類1、2類別藥品,按照《藥品注冊管理辦法》中新藥的程序申報;新注冊分類3、4類別藥品,按照《藥品注冊管理辦法》中仿制藥的程序申報;新注冊分類5類別藥品,按照《藥品注冊管理辦法》中進口藥品的程序申報。
新注冊分類2類別的藥品,同時符合多個情形要求的,須在申請表中一并予以列明。
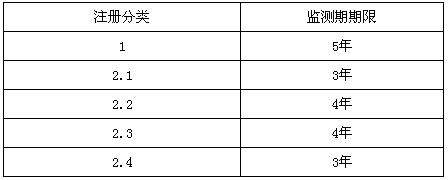
(三)根據《中華人民共和國藥品管理法實施條例》的有關要求,對新藥設立3—5年監測期,具體如下:
(四)本方案發布實施前已受理的化學藥品注冊申請,可以繼續按照原規定進行審評審批,也可以申請按照新注冊分類進行審評審批。如申請按照新注冊分類進行審評審批,補交相關費用后,不再補交技術資料,國家食品藥品監督管理總局藥品審評中心要設立綠色通道,加快審評審批。符合要求的,批準上市;不符合要求的,不再要求補充資料,直接不予批準。
(五)新注冊分類的注冊申請所核發的藥品批準文號(進口藥品注冊證/醫藥產品注冊證)效力與原注冊分類的注冊申請核發的藥品批準文號(進口藥品注冊證/醫藥產品注冊證)效力等同。
(六)國家食品藥品監督管理總局組織相關部門細化工作要求,做好受理、核查檢查、技術審評及制定、修訂相關國家藥品標準等工作。
(七)《藥品注冊管理辦法》與本方案不一致的,按照本方案要求執行。
網站聲明:
1、本網部分資訊為網上搜集轉載,為網友學習交流之用,不做其它商業用途,且均盡最大努力標明作者和出處。對于本網刊載作品涉及版權等問題的,請作者第一時間與本網站聯系,聯系郵箱:tignet@vip.163.com 本網站核實確認后會盡快予以妥當處理。對于本網轉載作品,并不意味著認同該作品的觀點或真實性。如其他媒體、網站或個人轉載使用,請與著作權人聯系,并自負法律責任。
2、凡本網注明"來源:虎網"的所有作品,版權均屬虎網所有,未經本網授權不得轉載、鏈接、轉貼或以其他方式使用;已經本網授權的,應在授權范圍內使用,且必須注明"來源:虎網"。違反上述聲明者,本網將追究其法律責任。